Recommandations – RFE
Optimisation hémodynamique périopératoire
Adulte dont obstétrique
Champ 1 – Optimisation périopératoire de la pression artérielle
Quels objectifs de pression artérielle permettent de diminuer la morbi-mortalité périopératoire ?
R.1.1 – Il est probablement recommandé d’éviter un niveau de pression artérielle moyenne (PAM) per opératoire inférieure à 60-70 mmHg, chez le patient non hypertendu chronique, afin de diminuer la morbimortalité postopératoire. (GRADE 2 – Accord fort)
- Association forte entre une PA basse et un risque accru de complications postopératoires : plus l’hypotension artérielle est profonde et prolongée, plus grand serait le risque de morbidité postopératoire.
Quels objectifs de pression artérielle permettent de diminuer la morbi-mortalité périopératoire chez le patient hypertendu chronique ?
R.1.2 – Les experts suggèrent de cibler un niveau de pression artérielle moyenne supérieur à 90% de sa valeur habituelle ou une pression artérielle moyenne supérieure à 70 mmHg chez les patients hypertendus chroniques, pour diminuer la morbi-mortalité postopératoire. (Avis d’expert – Accord fort)
Le monitorage continu de la pression artérielle permet-il de diminuer la morbi-mortalité périopératoire ?
Absence de recommandation – Après analyse de la littérature, les experts ne sont pas en mesure d’émettre une recommandation concernant l’impact du monitorage continu de la pression artérielle sur la morbimortalité périopératoire chez les patients à risque faible à intermédiaire. (Absence de recommandation – Accord fort)
Obstétrique
Chez les patientes ayant une césarienne programmée avec rachianesthésie, quel(s) objectif(s) de pression artérielle maternelle permet(tent) de diminuer la morbi-mortalité maternelle et néonatale ?
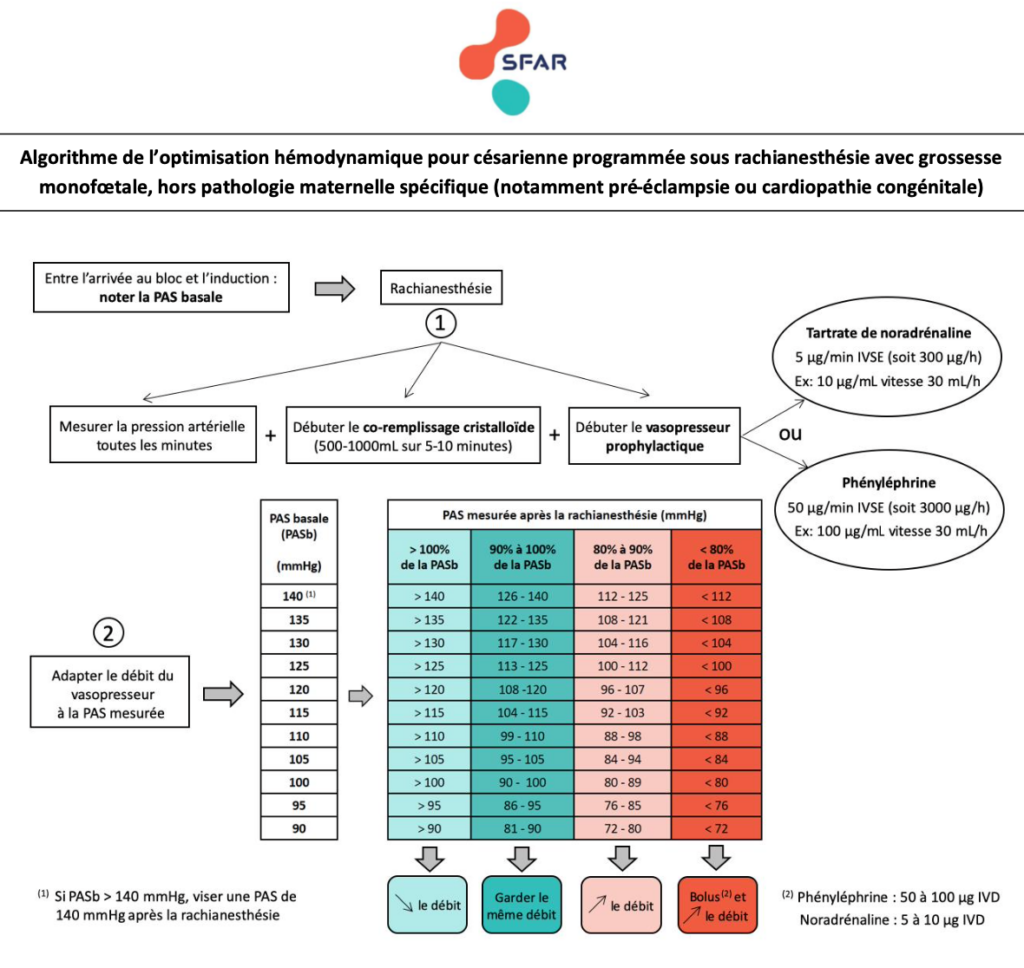
R.1.1 – Chez les patientes ayant une césarienne programmée avec rachianesthésie, il est probablement recommandé de maintenir la pression artérielle systolique maternelle entre 90 et 100% de la pression artérielle systolique mesurée avant l’induction de la rachianesthésie, afin de réduire l’incidence des nausées-vomissements. (GRADE 2 – Accord fort)
- L’hypotension secondaire à la rachianesthésie peut s’accompagner d’une activation réflexe du système parasympathique, pouvant entraîner une hyperactivité du tractus gastro-intestinal et favoriser les vomissements.
R.1.2 – Chez les patientes ayant une césarienne programmée avec rachianesthésie, si la pression artérielle systolique est inférieure à 80% de la pression artérielle systolique mesurée avant la rachianesthésie, les experts suggèrent de traiter cette hypotension artérielle sans délai dans le but de réduire l’incidence de l’acidose néonatale. (Avis d’experts – Accord fort)
Champ 2 – Utilisation du volume d’éjection systolique et des indices dynamiques pour guider l’expansion volémique (transfusion exclue)
L’utilisation du monitorage peropératoire du volume d’éjection systolique et/ou des indices dynamiques pour optimiser l’expansion volémique permet-il de diminuer la morbi-mortalité périopératoire ?
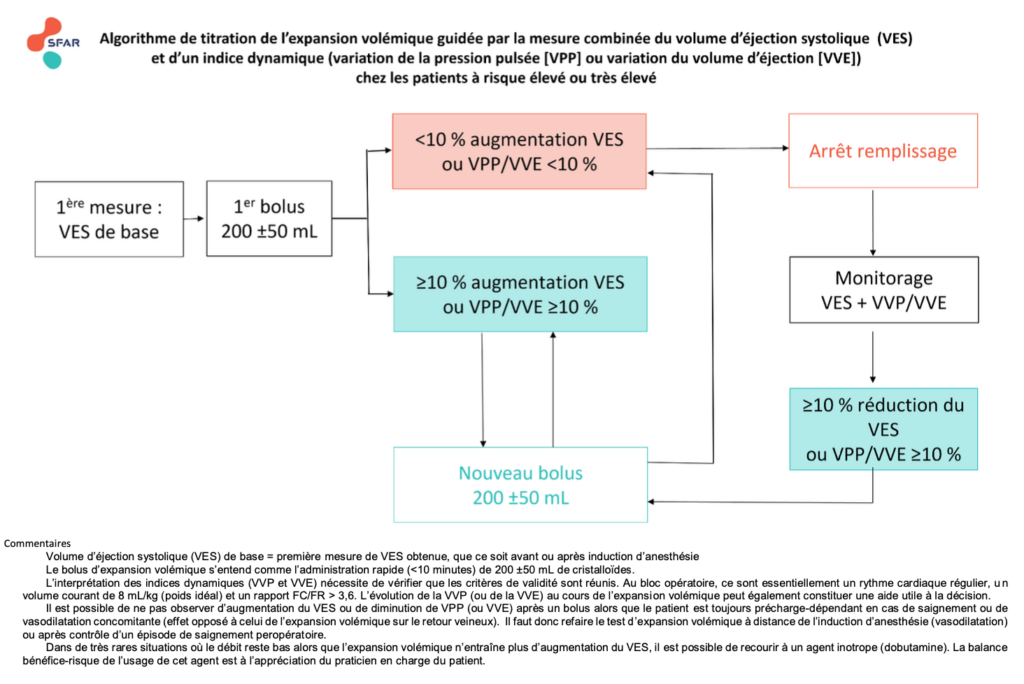
R2.1.1 – Il est probablement recommandé d’utiliser un monitorage du volume d’éjection systolique par Doppler oesophagien ou par analyse de la courbe de pression artérielle (via un cathéter artériel) afin de diminuer la morbidité périopératoire chez les patients à risque élevé et très élevé. (GRADE 2 – Accord fort)
R2.1.2 – En cas de monitorage du volume d’éjection systolique par analyse de la courbe de pression artérielle (via un cathéter artériel), il est probablement recommandé d’associer la mesure d’un indice dynamique, variations de la pression pulsée (VPP) ou variations du volume d’éjection systolique (VVE), pour optimiser l’expansion volémique et diminuer la morbidité périopératoire chez les patients à risque élevé et très élevé. (GRADE 2 – Accord fort)
Absence de recommandation – Il n’est pas possible de formuler de recommandation quant à l’utilisation d’un indice dynamique seul pour diminuer la morbidité périopératoire chez les patients à risque élevé ou très élevé. (Absence de recommandation – Accord fort)
R2.1.3 – Il n’est probablement pas recommandé d’utiliser un monitorage du volume d’éjection systolique ou un indice dynamique ou l’association des deux pour diminuer la morbidité périopératoire chez les patients à risque faible ou intermédiaire. (GRADE 2 – Accord fort)
Champ 3 – Utilisation des indices de perfusion tissulaire
L’utilisation du monitorage du lactate artériel, de la saturation veineuse centrale en oxygène (SvO2 centrale : ScVO2) et/ou de la différence artério-veineuse en CO2 (DIVA-CO2) pour optimiser l’hémodynamique permet-elle de diminuer la morbi-mortalité périopératoire ?
R3.1 – Chez les patients à risque très élevé, les experts suggèrent d’intégrer le dosage du lactate artériel dans le schéma d’optimisation hémodynamique pour diminuer la morbi-mortalité périopératoire. (Avis d’expert – Accord fort)
- Il existe une association entre une lactatémie élevée et une plus grande survenue de souffrance myocardique péiopératoire et/ou d’insuffisance rénale aiguë en postopératoire.
R3.2 – Il n’est probablement pas recommandé d’utiliser le monitorage de la saturation veineuse centrale en oxygène (ScVO2) pour diminuer la morbi-mortalité périopératoire. (GRADE 2 – Accord fort)
Absence de recommandation – Après analyse de la littérature, les experts ne sont pas en mesure d’émettre une recommandation concernant l’impact du monitorage de la différence artério-veineuse en CO2 (DIVA-CO2) sur la morbi-mortalité périopératoire. (Absence de recommandation – Accord fort)
- La mesure de la DIVA-CO2 nécessite la mise en place d’un cathéter veineux central, une mesure invasive de la pression artérielle et des mesures répétées de gaz du sang. Toutes ces conditions en limitent la répétabilité chez un patient et dans le temps.
L’utilisation du monitorage de la perfusion/oxygénation tissulaire par spectrométrie dans le proche infrarouge (NIRS) pour optimiser l’hémodynamique permet-elle de diminuer la morbi-mortalité périopératoire ?
Absence de recommandation – Après analyse de la littérature, les experts ne sont pas en mesure d’émettre une recommandation concernant l’utilisation du monitorage de la perfusion/oxygénation tissulaire par spectrométrie dans le proche infrarouge (NIRS) en chirurgie non cardiaque adulte pour diminuer la morbi-mortalité périopératoire. (Absence de recommandation – Accord fort)
Champ 4 – Expansion volémique (hors transfusion) et/ou vasoconstricteurs et/ou inotropes
Quel soluté d’expansion volémique présente le meilleur rapport efficacité/sécurité pour optimiser l’hémodynamique périopératoire ?
R4.1 – Il est probablement recommandé d’utiliser des solutés cristalloïdes balancés pour réaliser l’expansion volémique des patients de chirurgie non cardiaque afin de préserver leur équilibre acido-basique. (Grade 2 – Accord fort)
- Les solutés cristalloïdes balancés sont moins délétères que le sérum salé isotonique pour le PH postopératoire.
- Parmi les solutés balancés, un avantage se dessine pour le Plasmalyte et les solutés à base d’acétate par rapport aux solutés à base de lactate comme le Ringer Lactate. Ces derniers ont tendance à augmenter la lactatémie sans que ceci soit associé à des effets mesurables sur le pronostic des patients.
L’utilisation d’un vasoconstricteur (et lequel ?) dans le cadre de l’optimisation hémodynamique permet-elle de diminuer la morbi-mortalité péripératoire ?
R4.2.1 – Dans le cadre d’un protocole d’optimisation hémodynamique, lorsque le volume d’éjection systolique a déjà été optimisé par l’expansion volémique, les experts suggèrent d’utiliser un vasoconstricteur pour diminuer la morbi-mortalité périopératoire. (Avis d’experts – Accord fort)
R4.2.2 – Dans le cadre d’un protocole d’optimisation hémodynamique, lorsqu’un vasoconstricteur est nécessaire, les experts suggèrent de privilégier une perfusion de noradrénaline comparativement à une perfusion de phényléphrine pour un meilleur maintien du débit cardiaque. (Avis d’experts – Accord fort)
L’utilisation d’un inotrope (et lequel) dans le cadre de l’optimisation hémodynamique permet-elle de diminuer la morbi-mortalité périopératoire ?
R4.3.1 – En cas de persistance d’un index cardiaque inadapté après optimisation du volume d’éjection systolique par expansion volémique et de la pression artérielle par vasoconstricteurs, les experts suggèrent d’utiliser un inotrope dans le cadre d’une optimisation hémodynamique pour diminuer la morbidité périopératoire. (Avis d’experts – Accord fort)
R4.3.2 – Si un inotrope doit être utilisé en raison d’un index cardiaque inadapté, les experts suggèrent d’utiliser la dobutamine en première intention pour diminuer la morbidité postopératoire. (Avis d’experts – Accord fort)
- Lorsqu’un inotrope est introduit en peropératoire, cela nécessite une réévaluation cardiaque en postopératoire. Si la défaillance cardiaque persiste, une évaluation échocardiographique et un avis spécialisé sont nécessaires.
Obstétrique
Chez les patientes ayant une césarienne programmée avec rachianesthésie, l’utilisation d’un vasoconstricteur (et lequel ?) permet-elle de diminuer la morbi-mortalité maternelle et/ou néonatale ? Selon quelles modalités ?
R4.1 – Chez les patientes ayant une césarienne programmée avec rachianesthésie, il n’est pas recommandé d’utiliser de l’éphédrine en traitement prophylactique en comparaison avec la phényléphrine ou la noradrénaline afin de réduire le risque d’acidose néonatale, d’hypotension artérielle, de nausées-vomissements et de tachycardie maternelle. (Grade 1 – Accord fort)
- L’éphédrine passe très fortement la barrière placentaire et peut provoquer une stimulation catécholaminergique foeto-placentaire, entraînant une production de CO2 et de lactate avec une acidose néonatale potentiellement délétère.
- L’action retardée et épuisable de l’éphédrine semble, en théorie, moins efficace pour maintenir une stabilité hémodynamique maternelle.
- L’éphédrine est le moins bon vasoconstricteur concernant le risque de tachycardie réactionnelle maternelle, qu’il favorise nettement.
R4.2 – Chez les patientes ayant une césarienne programmée avec rachianesthésie, il est recommandé d’utiliser de la phényléphrine ou de la noradrénaline faiblement concentrée en traitement prophylactique pour réduire l’incidence de l’hypotension artérielle, des nausées-vomissements, de la tachycardie, des sensations de dyspnée et de malaise maternels, ainsi que de la lactatémie artérielle néonatale. (Grade 1 – Accord fort)
- Le débit de dose prophylactique initial suggéré de tartrate de noradrénaline est de 5 µg/min (300 µg/h) IVSE, et de 5 à 10 µg IVD en dose-bolus curative en cas d’hypotension.
4.3 – Absence de recommandation. Au vu des données actuelles de la littérature, il n’y a pas d’arguments suffisants permettant de recommander l’utilisation de la noradrénaline plutôt que la phényléphrine comme vasoconstricteur prophylactique (Absence de recommandation – Accord fort)
Chez les patientes ayant une césarienne programmée avec rachianesthésie, quelles modalités d’expansion volémique permettent de réduire la morbi-mortalité maternelle et/ou néonatale ?
R4.4 – Chez les patientes ayant une césarienne programmée avec rachianesthésie, conjointement à l’administration prophylactique de phényléphrine ou de noradrénaline, les experts suggèrent d’utiliser une expansion volémique rapide par cristalloïdes dès l’induction de la rachianesthésie (appelé co-remplissage) pour réduire l’incidence de l’hypotension artérielle et les besoins en vasoconstricteurs. (Avis d’experts – Accord fort)
- Il semble pertinent pour un rapport bénéfices/risques optimal, de se limiter à l’administration de 1000ml au maximum, et de l’effectuer le plus rapidement possible dans les 5-10 premières minutes suivant l’induction de la rachianesthésie.
Champ 5 – Impact économique de l’optimisation hémodynamique périopératoire
L’optimisation hémodynamique périopératoire permet-elle de diminuer la durée moyenne de séjour et les coûts liés aux soins ?
R5.1 – Il est probablement recommandé chez le patient à risque élevé et très élevé d’optimiser l’hémodynamique pour diminuer la durée moyenne de séjour. (GRADE 2 – Accord fort)
Absence de recommandation – Après analyse de la littérature, les experts ne sont pas en mesure d’émettre une recommandation concernant l’impact de l’optimisation hémodynamique périopératoire sur les coûts liés aux soins.
Pour résumer ..

Télécharger la fiche en pdf
Mis à jour le 02/04/2024
Auteur : Julie VIOLET

